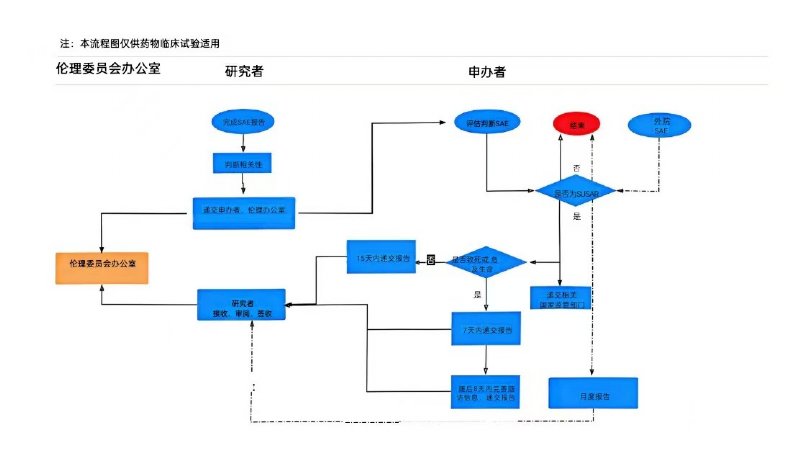
为落实《药物临床试验质量管理规范》(2020年7月1日施行)等要求,切实做好我院临床试验安全性事件报告及管理工作,及时发现并处理可能具有潜在风险的研究项目,更好地保护受试者安全和权益,特要求如下,请各研究者和申办者能够积极配合并予以遵守:
1. 严重不良事件(SAE)的报告
(1)本院SAE:应在获知后24h内报告给伦理委员会,随后及时补充随访、总结报告。
(2)外院SAE:由申办者进行分析评估后,快速报告可疑且非预期严重不良反应即可。
2. 可疑且非预期严重不良反应(SUSAR)的报告
(1)本院SUSAR递交时限:
对于致死或危及生命的非预期严重不良反应,申办者应在首次获知后尽快报告,但不得超过7天,并在随后的8天内报告、完善随访信息(申办者首次获知当天为第0天);
对于非致死或危及生命的非预期严重不良反应,申办者应在首次获知后尽快报告,但不得超过15天。
(2)非本院SUSAR递交时限:按月度报告给伦理委员会,同时递交临床试验部备案。
(3)报告要求:一般要求申办者递交主要研究者签字后,再递交伦理审查;如遇特殊情况,可由申办者直接递交伦理审查,但需附上主要研究者已获知的证明材料。
(4)报告形式
本院SUSAR递交形式:纸质版材料递交至伦理办公室签收。
非本院SUSAR递交形式:纸质版材料需以月报的形式递交至伦理办公室签收。如果申办者有比月报更高频率向伦理报告SUSAR的要求,可以发送邮件至635791633@qq.com,伦理秘书将邮件回复予以签收,纸质材料仍需以月报的形式递交。
(5)审查形式
可疑且非预期严重不良反应的伦理审查一般为快速审查,如涉及严重问题危及受试者安全,可召开紧急伦理会议审查;对于本院发生SUSAR的相关后续处理,作为临床试验部在项目质控工作中的重点内容。
(6)材料要求:不接收英文材料。